Tumeurs mammaires de la chienne : le Cancer Mammaire Inflammatoire
Les pathologistes du laboratoire vétérinaire LAPVSO ont assisté pour vous à
Canine and feline mammary tumors : new trends from old diseases
3 th- 5th November 2011
Institut Pasteur, Paris
25, rue du Docteur Roux – Paris
Pr Valentina Zappulli
(Padova, Italy)
Pr Robert Klopfleisch
(Berlin, Germany)
Pr Laura Peña Fernandez
(Madrid, Spain)
Les tumeurs mammaires sont les néoplasies les plus fréquentes de la chienne, puisqu’elles représentent environ 50% de toutes les tumeurs pouvant l’affecter. Environ 50% d’entre elles sont malignes. Le cancer mammaire inflammatoire est une forme rare de tumeur mammaire de la chienne, qui se démarque par son développement brutal, son évolution fulminante et son pronostic sombre.
Un modèle pour la pathologie comparée
Le cancer mammaire inflammatoire (CMI) de la chienne est proposé comme modèle spontané du CMI de la femme avec lequel il partagerait des caractéristiques cliniques, histologiques et vraisemblablement génétiques et biologiques. Dans les deux espèces, il s’agit d’une forme de cancer mammaire localement très agressif dont le pronostic s’avère sombre. Chez la femme son incidence est de 1 à 5%, chez la chienne de 7,6% des tumeurs mammaires (4) [il représenterait 17,7% de toutes les tumeurs mammaires malignes de la chienne (2)]. Dans ces deux espèces, l’incidence semble s’accroître depuis ces dernières années, la femme et la chienne étant vraisemblablement exposées aux mêmes carcinogènes environnementaux et nutritionnels, l’animal partageant souvent étroitement la vie de ses maîtres (4). La dénomination inflammatoire vient de l’aspect macroscopique des lésions se manifestant par une peau très enflammée et indurée avec œdème, érythème, chaleur et douleur, mimant un processus pathologique inflammatoire, comme une dermatite ou une mammite (1). Il s’agit dans les deux espèces de la forme de cancer mammaire la plus agressive.
Aspects cliniques
Le cancer mammaire inflammatoire n’est pas un type histologique de tumeur mammaire maligne, mais une entité clinique à part entière de survenue brutale et d’évolution fulminante. Il peut être primitif ou secondaire, c’est à dire apparaître avec ou sans antécédent de tumeur mammaire maligne. La forme secondaire se manifeste soit en post-opératoire après retrait d’une tumeur mammaire initiale, soit sans que cette tumeur mammaire primitive n’ait fait l’objet d’une exérèse chirurgicale préalable. Cette éventuelle tumeur mammaire primitive ne présente pas les caractéristiques d’un CMI (6). Les signes cliniques apparaissent en moyenne en 4,5j : en 2 à 7j dans un CMI primaire et 1 à 10j après la chirurgie d’une tumeur primitive dans les CMI secondaires (étude sur 12 cas)(6).
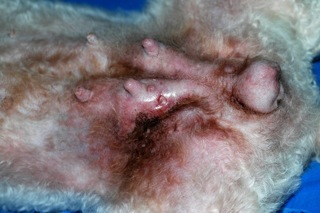
Le CMI peut atteindre plusieurs glandes mammaires d’emblée (en moyenne 2, avec une forte prévalence sur M4 et M5) (6). La peau est indurée, épaissie, érythémateuse, chaude, douloureuse. Des nodules peuvent être ou non présents (Fig 1 & 2). Dans une forte proportion des cas l’œdème sous-cutané et musculaire s’étend aux membres (le plus souvent les postérieurs), ce qui peut entraîner une boiterie de la chienne.
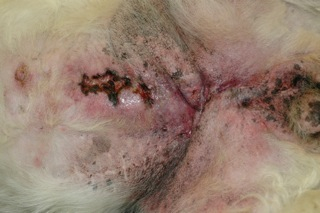
Fig 1 : Aspect érythémateux, œdémateux, induré, épaissi, douloureux de la peau des mamelles abdominales postérieures des deux chaînes mammaires et de la face interne de la peau des cuisses (photo Dr C. Muller).
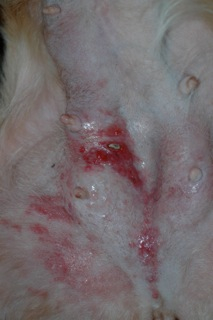
Fig 2 : Aspect érythémateux, œdémateux, suintant, induré, épaissi, douloureux, focalement ulcéré de la peau des mamelles abdominales postérieures des deux chaînes mammaires et de la face interne de la peau des cuisses (photo Dr C. Muller).
Aspects histologiques
Plusieurs types histologiques de tumeurs mammaires malignes peuvent donner lieu au développement d’un cancer mammaire inflammatoire :
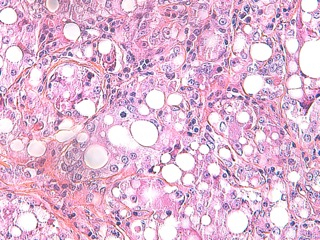
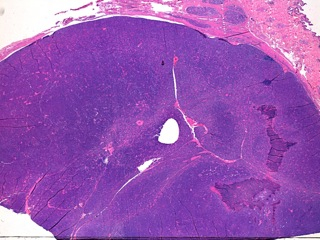
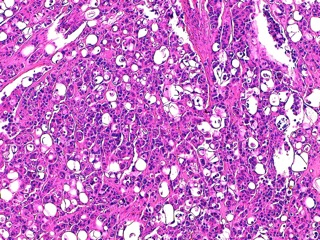
- Le carcinome à cellules lipidiques (Fig 3)
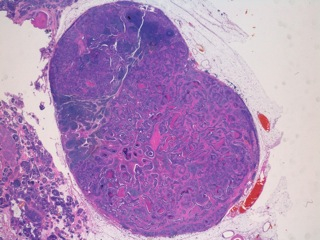
- Le comédocarcinome (Fig 4, 5)
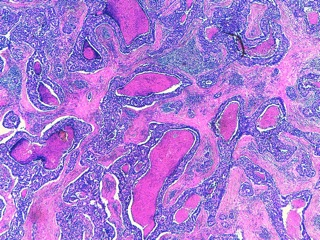
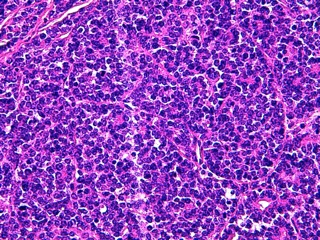
- Le carcinome solide (Fig 6, 7)
- Le carcinome anaplasique (Fig 8,12)
- Le carcinosarcome
- les sarcomes…(4,12).
Histologiquement, on ne constate pas de remaniements inflammatoires particuliers du tégument, l’aspect macroscopique inflammatoire n’est pas en relation avec un quelconque infiltrat inflammatoire du derme.
Par contre, on retrouve dans chaque cas, un œdème sous-cutané et musculaire de toute la région mammaire atteinte, le plus souvent associé à une infiltration tumorale du tissu adipeux et musculaire (Fig 11,12).
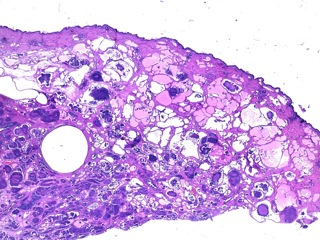
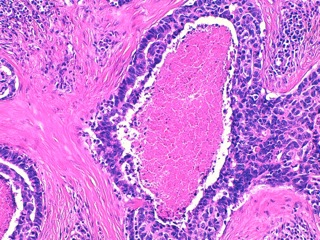
Fig 9 : Cancer mammaire inflammatoire : embolisation tumorale massive dans les vaisseaux lymphatiques dermiques ectasiés
(HE X 20).
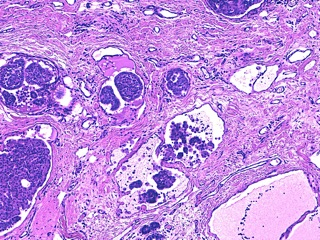
Fig 10 : Cancer mammaire inflammatoire : les vaisseaux lymphatiques dermiques sont gorgés de cellules tumorales embolisées
(HE X 100).
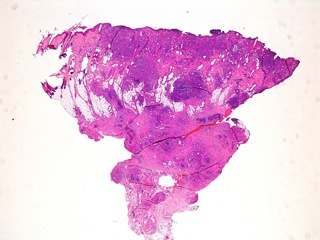
Fig 11 : Cancer mammaire inflammatoire : infiltration tumorale massive du derme, de l’hypoderme et du tissu mammaire
(HE X 20).
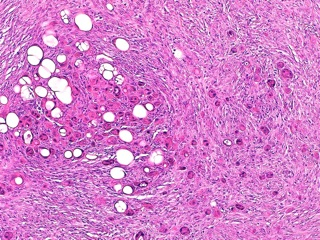
Fig 12 : Cancer mammaire inflammatoire : infiltration tumorale massive du derme par des cellules tumorales anaplsiques en bague à chaton, dispersée au sein d’une dense stroma réaction fibreuse (acrcinome anaplasique)
(HE X 100) (même cas que Fig 11 à un grossissement supérieur).
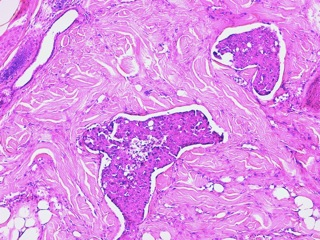
Fig 13 : Cancer mammaire inflammatoire : les vaisseaux lymphatiques dermiques sont gorgés de cellules tumorales embolisées
(HE X 100) (même cas que Fig 11 à un grossissement supérieur).
Diagnostic
Il repose sur l’existence de manisfestations cliniques, histologiques et évolutives particulières :
- Evolution soudaine, extensive, fulminante,
- Aspect inflammatoire : érythémateux, œdémateux, douloureux et chaud, ainsi qu’induration localisée ou extensive de la peau d’une ou plusieurs mamelles,
- Découverte histologique d’un envahissement massif des vaisseaux lymphatiques dermiques par des emboles d’une tumeur mammaire de haut grade de malignité.
Evolution : des sites métastatiques particuliers
Dans 81 à 100% des cas (2,9,12), le CMI développe des métastases à distance, qui contrairement aux autres tumeurs mammaires malignes affectent moins les poumons, peu le rein et le foie et peu voire jamais les os, mais de façon toute particulière la vessie et l’appareil génital (ovaires, utérus, vagin), ces deux organes ne faisant pas partie des sites métastatiques habituels des autres cancers mammaires de la chienne (11) (Tableau I). L’envahissement métastatique de la vessie se manifeste par un épaississement pariétal œdémateux et diffus de cet organe sans formation de nodules dans la séreuse, ni d’inflammation particulière. Il ne s’agit pas d’un envahissement vésical par invasion locale directe de la paroi abdominale via le péritoine, mais d’une embolisation tumorale massive. Cette différence de comportement métastatique propre au CMI serait dû à un profil endocrinien, invasif, angiogénétique et lymphangiogénique très particulier (3,10).
Tableau I : comparaison des sites métastatiques entre cancers mammaires inflammatoires et autres tumeurs mammaires malignes (qui ne sont pas des CMI) d’après Clemente et al 2010 (11)
| Organe | Cancers Mammaires Inflammatoires (CMI) n= 39 % | Tumeurs mammaires malignes (non CMI) n=33% |
|---|---|---|
| Nœuds lymphatiques régionaux | 94,9 | 100 |
| Poumon* | 74,4 | 93,9 |
| Coeur | 5,1 | 6,1 |
| Rate | 2,6 | 12,1 |
| Foie* | 2,6 | 24,2 |
| Reins* | 2,6 | 21,2 |
| Pancréas | 0 | 3 |
| Glandes surrénales | 2,6 | 6,1 |
| Vessie* | 17,9 | 0 |
| Appareil génital* (ovaires, utérus) | 10,5 | 0 |
| Cerveau | 0 | 9,1 |
| Os* | 0 | 12,1 |
| Muscle | 0 | 9,1 |
Un profil antigénique très particulier
L’angiogenèse, c’est la formation de nouveaux vaisseaux à partir de vaisseaux pré-existants chez l’adulte. L’angiogenèse tumorale peut se développer à partir de précurseurs médullaires de cellules endothéliales, des cellules endothéliales de vaisseaux pré-existants, mais récemment un nouveau mode a été découvert : c’est le mimétisme vasculaire (« vascular or vasculogenic mimicry » des anglo-saxons) (VM). VM est la formation de novo de canaux vasculaires par les cellules tumorales elles-mêmes, sans aucune participation de cellules endothéliales. Il s’agit d’une dérégulation génétique agressive des cellules tumorales. Les canaux ne sont pas formés à partir de vaisseaux pré-existants, ce ne sont pas de réels vaisseaux sanguins, mais ils sont néanmoins capables de distribuer du plasma et des érythrocytes, voire des cellules tumorales et des leucocytes : ils miment les vaisseaux sanguins, voire les vaisseaux lymphatiques et usurpent littéralemement leur fonction (10). Ce phénomène est déjà connu dans certains cancers humains particulièrement agressifs. Il vient d’être décrit dans les tumeurs mammaires malignes de la chienne et serait plus fréquent dans le CMI que dans les non CMI (10).
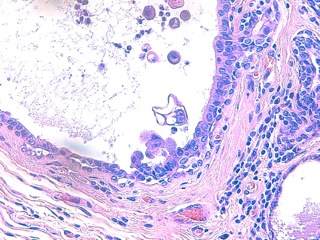
Fig 15 : Cancer mammaire inflammatoire : mimétisme vasculaire des cellules tumorales : elles peuvent former des canaux, entre elles ou au sein même de leur cytoplasme, canaux qui peuvent héberger d’autres cellules tumorales, des érythrocytes et même des cellules inflammatoires, mimant et usurpant la fonction des vaisseaux sanguins voire lymphatiques (HE X 400)
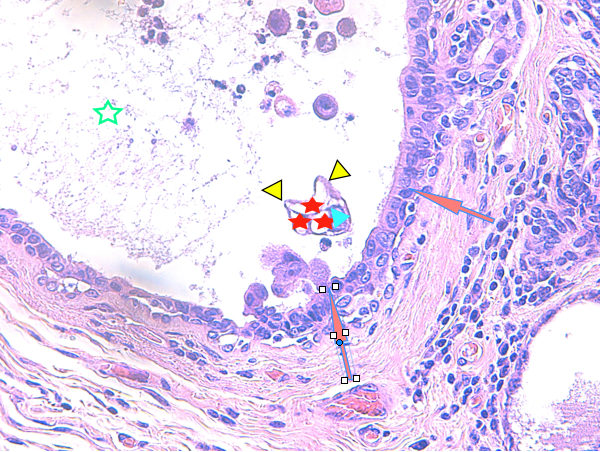
Fig 16 : Légendes de la Fig 15 : flèches oranges = limites d’un tubule tumoral, étoile vert = lumière du tubule,pointe de flèche turquoise = noyau d’une cellule tumorale, pointe de flèche jaune = limites cytoplasmiques de la cellule tumorale, dessinant le contour de canaux, étoile rouge = lumière des canaux.
Pronostic : un bilan d’extension particulier à prévoir
Le pronostic du CMI est sombre, d’une part en raison d’un risque élevé de récidive locale après exérèse chirurgicale (les récidives survenant dans les semaines et maximum 1 mois suivant la chirurgie) et d’autre part en raison du risque élevé de diffsion métastatique. Le temps moyen de survie est de 25j chez 20 chiennes ayant reçu un traitement palliatif (antibiothérapie et corticothérapie) alors qu’il n’est que de 14 mois chez 79 chiennes atteintes de tumeurs mammaires malignes (non CMI) et varie, selon les études, de 25 à 60 jours (survie de 1 à 300j) quel que soit le traitement adopté (2,6,8,9). Un bilan d’extension complet et soigneux est impératif avec exploration de l’ensemble des deux chaînes mammaires et du tégument environnant, des nœuds lymphatiques de drainage (Tableau I), du thorax et de l’abdomen (radiographies thoraciques et échographie abdominale notamment vésicale et de l’appareil génital). L’exploration de l’hémostase est souhaitable [car il existe un risque de coagulopathie / CIVD dont la survenue assombrit encore le pronostic – dans 21% des cas (9)].
Quel traitement ?
Il n’y a pas à l’heure actuelle de traitement recommandé chez la chienne. La chirurgie seule n’est pas conseillée. Chez la femme, un traitement d’emblée multimodal associant chimiothérapie et radiothérapie avant et/ou après la chirurgie, a amélioré la survie des patientes, mais le pronostic demeure sombre. Chez la chienne des traitements chimiothérapiques (mitoxantrone seule ou combinée à la vincristine et au cyclophosphamide) avaient déjà été signalés comme augmentant la médiane de survie par rapport à des traitements uniquement palliatifs (survie médiane passant de 35 à 57j avec traitement chimiothérapique)(7). Récemment, le CMI a révélè un profil immunohistochimique particulier exprimant une forte positivité au Cox-2 (5). L’expression du Cox-2 est positivement corrélée à la malignité du processus mammaire cancéreux et à la pauvreté du pronostic (5). Parmi les tumeurs mammaires malignes de la chienne, c’est le CMI qui exprime le taux le plus fort (5). Cette forte expression du Cox-2, suggère l’intérêt d’un traitement palliatif aux AINS COX-2 sélectifs. D’après une étude récente (6) portant sur 12 chiens atteints de CMI, il semblerait qu’une amélioration de l’aspect clinique des lésions (aspect moins érythémateux, moins œdémateux, moins douloureux) et de la qualité de vie (augmentation de l’activité et de l’appétit) ait été observée chez tous les chiens traités au piroxicam (0,3mg/kg/j per os) avec une survie moyenne et médiane, sans progression, de 171 et de 183 jours, respectivement. La médiane de survie de 3 chiens traités avec des protocoles à base de doxorubicine était de 7 jours, alors que celle des chiens traités au piroxicam était de 185 jours. Compte-tenu des mécanismes angiogénétiques particuliers du CMI, le développement de nouvelles thérapies anti-angiogéniques devraient également être susceptible d’améliorer la survie des sujets atteints.
Pour en savoir plus
- Ginel PJ, Pérez J, Lucena R, Mozos E. : Vesiculopustular dermatitis associated with cutaneous metastases of an inflammatory mammary carcinosarcoma in a bitch. Vet Rec. 2000 Nov 4;147(19):550-2.
- Pérez Alenza MD, Tabanera E, Peña L. : Inflammatory mammary carcinoma in dogs: 33 cases (1995-1999).
J Am Vet Med Assoc. 2001 Oct 15;219(8):1110-4. - Peña L, Silván G, Pérez-Alenza MD, Nieto A, Illera JC. : J Steroid Biochem Mol Biol. 2003 Feb;84(2-3):211-6. Steroid hormone profile of canine inflammatory mammary carcinoma: a preliminary study.
- Peña L, Perez-Alenza MD, Rodriguez-Bertos A, Nieto A. : Canine inflammatory mammary carcinoma: histopathology, immunohistochemistry and clinical implications of 21 cases. Breast Cancer Res Treat. 2003 Mar;78(2):141-8.
- Queiroga FL, Perez-Alenza MD, Silvan G, Peña L, Lopes C, Illera JC. : Cox-2 levels in canine mammary tumors, including inflammatory mammary carcinoma: clinicopathological features and prognostic significance.
Anticancer Res. 2005 Nov-Dec;25(6B):4269-75. Erratum in: Anticancer Res. 2006 Jan-Feb;26(1a):446. - De M Souza CH, Toledo-Piza E, Amorin R, Barboza A, Tobias KM. : Inflammatory mammary carcinoma in 12 dogs: clinical features, cyclooxygenase-2 expression, and response to piroxicam treatment. Can Vet J. 2009 May;50(5):506-10.
- Clemente M, De Andrés PJ, Peña L, Pérez-Alenza MD. : Survival time of dogs with inflammatory mammary cancer treated with palliative therapy alone or palliative therapy plus chemotherapy.Vet Rec. 2009 Jul 18;165(3):78-81.
- Ness M. : Survival time of dogs with inflammatory mammary cancer.Vet Rec. 2009 Aug 29;165(9):272; author reply 272.
- Marconato L, Romanelli G, Stefanello D, Giacoboni C, Bonfanti U, Bettini G, Finotello R, Verganti S, Valenti P, Ciaramella L, Zini E. : Prognostic factors for dogs with mammary inflammatory carcinoma: 43 cases (2003-2008).J Am Vet Med Assoc. 2009 Oct 15;235(8):967-72.
- Clemente M, Pérez-Alenza MD, Illera JC, Peña L. : Histological, immunohistological, and ultrastructural description of vasculogenic mimicry in canine mammary cancer. Vet Pathol. 2010 Mar;47(2):265-74. Epub 2009 Dec 31.
- Clemente M, Pérez-Alenza MD, Peña L. : Metastasis of canine inflammatory versus non-inflammatory mammary tumours. J Comp Pathol. 2010 Aug-Oct;143(2-3):157-63. Epub 2010 Apr 27.
12- Sorenmo KU, Rasotto R, Zappulli V, Goldschmidt MH : Development, anatomy, histology, lymphatic drainage, clinical features, and cell differentiation markers of canine mammary gland neoplasms. .Vet Pathol. 2011 Jan;48(1):85-97.